Данная информация предназначена для специалистов в области здравоохранения и фармацевтики. Пациенты не должны использовать эту информацию в качестве медицинских советов или рекомендаций.
Роль цитокинов при инфекции SARS-CoV-2 и пути блокады
цитокинового шторма
ВАСИЛЕВСКИЙ И.В.
Белорусский государственный медицинскимй университет, Минск, Республика
Беларусь
Резюме
В статье на основании современных литературных данных приводится комплексный
анализ проблемы роли цитокинов при новой короновирусной инфекции SARS-CoV-2
(COVID-19). Приведены сведения по иммунопатогенезу инфекции SARS-CoV-2.
Подчерки-вается тот факт, что тяжелая форма данного заболевания характеризуется
системным гипер-воспалением, острым респираторным дистресс-синдромом,
полиорганной недостаточно-стью, нередко приводящими к летальным исходам. Условно
называемый цитокиновый шторм, вызываемый чрезмерными иммунными реакциями,
признан ведущей причиной тяжелой формы инфекции SARS-CoV-2. По мере накопления
современных сведений по иммунопатогенезу новой короновирусной инфекции
SARS-CоV-2 (COVID-19) в настоящее время в реальной врачебной практике
используется несколько подходов для лечения наблю-даемого цитокинового шторма,
связанного с COVID-19. Практический интерес с позиций клинической фармакологии
представляют новые подходы к лечению инфекции SARS-CоV-2 (COVID-19), нацеленных
на блокаду цитокинов. В частности, это использование ингиби-торов IL-6 (тоцилизумаба,
сарилумаба), ингибиторов IL-1 (анакинры), ингибиторов пути янус-киназы (JAK) (барицитиниба).
В недавних исследованиях различных авторов реали-зация подобных подходов
показала многообещающий потенциал для лечения тяжелых форм COVID-19.
Представленная информация имеет большое практическое значение для практи-кующих
врачей.
Ключевые слова: инфекция SARS-CoV-2 (COVID-19), иммунопатогенез, цитокины,
цитокиновый шторм, лечение цитокинового шторма при SARS-CoV-2 (COVID-19),
практи-кующие врачи.
ROLE OF CYTOKINES IN SARS-CoV-2 INFECTION AND WAYS TO BLOCK CYTOKINE STORM
Vasilevski I.V.
Belarusian State Medical University, Minsk, Republic of Belarus
Summary
The article, based on modern literature data, provides a comprehensive
analysis of the problem of the role of cytokines in the new coronavirus
infection SARS-CoV-2 (COVID-19). Information on the immunopathogenesis of
SARS-CoV-2 infection is presented. The fact is emphasized that the severe form
of this disease is characterized by systemic hyperinflammation, acute
respiratory distress syndrome, multiple organ failure, often leading to death.
Conditionally called a cytokine storm caused by excessive immune responses, it
is recognized as the leading cause of severe SARS-CoV-2 infection. With the
accumulation of modern information on the immunopathogenesis of the new
coronavirus infection SARS-CoV-2 (COVID-19), several approaches are currently
being used in real medical practice to treat the observed cytokine storm
associated with COVID-19. Of practical interest from the standpoint of clinical
pharmacology are new approaches to the treatment of SARS-CoV-2 (COVID-19)
infection, aimed at blocking cytokines. In particular, this is the use of IL-6
inhibitors (tocilizumab, sarilumab), IL-1 inhibitors (anakinra), and Janus
kinase (JAK) inhibitors (baricitinib). In recent studies by various authors, the
implementation of such approaches has shown promising potential for the
treatment of severe forms of COVID-19. The information presented is of great
practical importance for practicing physicians.
Key words: SARS-CoV-2 (COVID-19) infection, immunopathogenesis, cytokines,
cytokine storm, treatment of the cytokine storm for SARS-CoV-2 (COVID-19),
medical practitioners.
В конце 2019 г. в Китайской Народной Республике (КНР) произошла вспышка новой
коронавирусной инфекции с эпицентром в городе Ухань (провинция Хубэй). Всемирная
организация здравоохранения (ВОЗ) 11 февраля 2020 г. определила официальное
название инфекции, вызванной новым коронавирусом, – COVID-19 («Coronavirus
disease 2019»). Международный комитет по таксономии вирусов 11 февраля 2020 г.
присвоил официальное название возбудителю инфекции – SARS-CoV-2. В настоящее
время мировым медицинским сообществом выработаны основные стратегические
направления лечения новой коронави-русной инфекции, основанные на анализе
постоянно обновляемых данных клинических исследований и реальной клинической
практики [1,2].
Коронавирус SARS-CoV-2 проникает в клетки-мишени, используя
ангиотензин-превращающий фермент 2-го типа (АПФ2) [3]. Высокий уровень
экспрессии рецепторов к АПФ2 обнаружен в разных органах и тканях человека (в
легких, сердце, некоторых отделах центральной нервной системы, почках,
сосудистом эндотелии, печени, яичках и кишечнике), что объясняет мультиорганное
повреждение при COVID-19. Благодаря S-белку (spike protein, поверхностный
шиповидный белок), который по своей структуре имитирует АПФ2, вирус-ные частицы
SARS-CoV-2 связываются с рецепторами АПФ2 на поверхности клеток-мишеней и
проникают внутрь клетки путем эндоцитоза [4]. Для входа в клетки хозяина вирус
SARS-CoV-2 использует и трансмембранную сериновую протеазу типа 2 (transmembra-ne
protease serine 2 — TMPRSS2), выступающую в роли кофактора активации S-белка
[5]. В инфицировании вирусом SARS-CoV-2 обсуждается роль протеазы ADAM17,
представля-ющей собой трансмембранный белок, и ее участия в расщеплении АПФ2 на
поверхности мембраны клетки с высвобождением растворимой формы АПФ2 в кровоток.
Основная мишень вируса SARS-CoV-2 — это альвеолярные клетки (альвеолоциты) II
типа легких, осуществляющие важные функции: синтез сурфактанта, лизоцима и
интерферона, нейтрали-зацию продуктов оксидативного стресса, регуляцию баланса
альвеолярной жидкости и транспорт ионов. Вирус SARS-CoV-2 является триггером
высвобождения провоспали-тельных цитокинов из активированных макрофагов.
Последующее развитие “цитокинового шторма” на фоне гиперактивации иммунной
системы содействует тяжелому поражению легочной ткани (и других органов) [6].
Poland G.A. et al. [7] в своей обстоятельной работе представили основные
этапы жизненного цикла вируса SARS-CoV-2 и развитие иммунного ответа на вирус.
Выделенные этапы согласно данным авторов следующие:
1. Присоединение вириона SARS-CoV-2 к поверхности клетки с помощью
взаимодействия с клеточным рецептором ангиотензинпревращающего фермента-2
(АПФ2).
2. Вход в клетку. Вирусные белки могут распознаваться рецепторами опознавания
паттерна (напр. Толл-подобные рецепторы - TLR2, TLR4 и TLR7), что приводит к
высвобождению молекулярных паттернов, связанных с опасностью воспалительного
ответа и активации противовирусных путей врожденного иммунитета.
3. Слияние мембран и высвобождение РНК в клетку.
4. Трансляция РНК для производства вирусных белков.
5. Геном РНК копируется и прикрепляется к нуклеокапсидному белку.
6. Формирование дочерних вирионов SARS-CoV-2.
7. Распознавание шиповидного гликопротеина и нуклеокапсидного белка
рецепторами B-клеток.
8. В-клетки производят антитела, связывающие шиповидный гликопротеин, и
нейтрализу-ющие антитела, нацеленные на рецепторсвязывающий домен (РСД)
шиповидного глико-протеина.
9. Захват вируса антигенпрезентирующими клетками (АПК).
10. Презентация антигенов, включая эпитопы структурных и неструктурных белков,
Т-клеткам.
11. Активация Th-клеток (CD4 + хелперных Т-лимфоцитов).
12. Активация цитотоксических Т-лимфоцитов (CD8 + Т-лимфоцитов).
13. Th-клетки производят цитокины (в основном IFN-γ, IL-2 и TNF-α).
14. Цитотоксические Т-лимфоциты распознают и убивают инфицированные клетки.
В условиях глобальной пандемии новой короновирусной инфекции SARS-CоV-2
(COVID-19) тяжесть клинической картины у пациента и прогноз заболевания связаны
с особенностями течения так называемого цитокинового шторма [8]. Синдром
высвобождения цитокинов, часто именуемый в литературе как «цитокиновый шторм» (англ.
cytokine storm, cytokine release syndrome) представляет собой особую форму
системной воспалительной реакции организма, характеризующейся чрезмерным
синтезом цитокинов в очаге воспале-ния. Цитокиновый шторм может развиться в
результате инфекционно-токсического шока, сепсиса, жёлтой лихорадки, лихорадки
Эбола, тяжелого острого респираторного синдрома, вызванного коронавирусом,
острого панкреатита, тяжелых травм, реакции отторжения трансплантата и.т.д. [9].
Исследования показали, что быстрое клиническое ухудшение и высокий риск
смертности при тяжелой форме COVID-19 могут быть связаны с цитокиновым штормом
[10].
Заболевание COVID-19, вызванное инфекцией SARS-CoV-2, связано с рядом
патоло-гических механизмов, которые мобилизуют широкий спектр биомолекул, в
основном имму-нологических по своей природе. В наиболее тяжелых случаях прогноз
может значительно ухудшиться из-за гиперпродукции в основном провоспалительных
цитокинов, таких как IL-1, IL-6, IL-12, IFN-γ и TNF-α, преимущественно
нацеленных на легочную ткань [11]. Повышение уровня провоспалительных цитокинов,
опосредованных ранним иммунным ответом, может привести к цитокиновому шторму,
который, как известно, является причиной критических заболеваний, воспалительных
нарушений, полиорганных поврежде-ний и, следовательно, смертности от инфекции
COVID-19. Известно, что пациенты, испытывающие этот феномен, имеют худший
прогноз, чем те, кто не подвержен гипервоспа-лительным явлениям, и у них с
большей вероятностью разовьется вызванный выбросом цитокинов синдром острого
респираторного дистресс-синдрома (ОРДС) в качестве клини-ческих проявлений.
Пациенты с ОРДС испытывают гипоксемическую дыхательную недо-статочность,
сопровождающуюся тяжелыми нарушениями функций легких, двусторонней инфильтрацией
на снимках грудной клетки [12]. В норме сама иммунная система со временем
подавляет это воспаление и человек выздоравливает. Но при инфицировании
коронавирусом чаще, чем во многих других случаях, бывает, что тормозящие
механизмы иммунной системы не срабатывают. В худшем варианте развития событий
это приводит к гиперцитокинемии. В этом случае имеет место полиорганное
поражение, когда в патологи-ческий процесс вовлекается весь организм, могут
поражаться даже почки и сердце. И, конечно, кроме прочего, развивается ОРДС.
Другими словами, в масштабных повреждениях может принимать участие уже не вирус,
который запустил агрессивный ответ, а непосред-ственно иммунная система человека,
которая вышла из-под контроля.
Хотя многие факторы этой инфекции и ее последствия в настоящее время не
совсем ясны, наличие и участие определенных хемокинов, несомненно, имеет
решающее значение для развития и прогрессирования COVID-19. Цитокиновый шторм и
часто возникающий синдром высвобождения цитокинов (СВК) являются
патофизиологическими признаками инфекции COVID-19, связанных с его наиболее
тяжелыми и смертельными случаями [13]. Пожилой возраст и наличие ранее
существовавших сопутствующих заболеваний считаются факторами риска более
тяжелого течения и смертности COVID-19 [14]. В настоящее время очень часто
встречающийся и широко обсуждаемый термин в этом контексте - это так называемый
феномен цитокинового шторма, проявляющийся как событие, характеризую-щееся
молниеносной гиперактивностью иммунных клеток, продуцирующих провоспалитель-ные
цитокины, называемое гиперцитокинемией, которая может привести к тяжелой или
даже опасной для жизни полиорганной недостаточности [15]. Тяжелая форма новой
короновирус-ной инфекции SARS-CоV-2 (COVID-19) характеризуется системным
гипервоспалением, острым респираторным дистресс-синдромом (ОРДС) и полиорганной
недостаточностью, часто приводящей к летальным исходам.
Критическая форма COVID-19 является разновидностью цитокинового шторма, а ее
проявления сходны с течением первичного и вторичного гемофагоцитарного
лимфогистио-цитоза (ГЛГ) или синдрома активации макрофагов (САМ). При
критическом течении COVID-19 развивается патологическая активация врожденного и
приобретенного иммуни-тета, дисрегуляция синтеза провоспалительных,
иммунорегуляторных, антивоспалительных цитокинов и хемокинов: ИЛ1, ИЛ2, ИЛ6,
ИЛ7, ИЛ8, ИЛ9, ИЛ10, ИЛ12, ИЛ17, ИЛ18, гранулоцитарного колониестимулирующего
фактора (Г-КСФ), гранулоцитарно-макрофагаль-ного колониестимулирующего фактора (ГМ-КСФ),
фактора некроза опухоли α (ФНОα), ИФНγ-индуцируемого белка 10, ИФНα и ИФНβ,
моноцитарного хемоаттрактантного белка 1 (МХБ1), макрофагального воспалительного
белка 1α (МВБ1α), а также маркеров воспаления (СРБ, ферритина). Отличие
COVID-19-индуцированного вторичного ГЛГ от других форм вирус-индуцированного
цитокинового шторма заключается в том, что органом-мишенью при этом варианте
цитокинового шторма являются в первую очередь легкие, что связано с тропизмом
коронавируса к легочной ткани. Гиперактивация иммунного ответа при COVID-19
часто ограничивается легочной паренхимой, прилегающей бронхиальной и
альвеолярной лимфоидной тканью, и ассоциируется с развитием ОРДС.
Непосредственный иммунный ответ на инфекцию, вызванную вирусами, бактериями
или другими микроорганизмами, включает мобилизацию клеток и молекул и использует
энергетические, ферментативные и биосинтетические ресурсы; т.е. метаболические
ресурсы. Цитокины представляют собой группу сигнальных молекул полипептидов,
ответственных за регулирование большого количества биологических процессов через
рецепторы клеточной поверхности [16]. Ключевые цитокины включают те, которые
участвуют в адаптивном иммунитете (например, IL-2 и IL-4), провоспалительные
цитокины и интерлейкины (IL) (например, интерферон (IFN) -I, -II и -III; IL-1,
IL- 6 и IL-17 и TNF-α); и противовоспа-лительные цитокины (например, IL-10). В
ответ на вызывающие стресс внутренние процессы (например, рак или микробная
инфекция) клетки-хозяева секретируют цитокины, играющие очень важную роль в
перепрограммировании клеточного метаболизма в качестве защитной реакции [17].
Ключевым моментом в инфекции SARS-CoV-2 может быть истощение противовирусной
защиты, связанное с врожденным иммунным ответом, а также повышенная продукция
воспалительных цитокинов [18].
Какие же клинические последствия повышения уровней цитокинов необходимо
вспомнить? Гиперцитокинемия может привести к глубоким изменениям в
тканях-мишенях и физиологии хозяина, когда ни один орган не щадится и выживание
хозяина находится под угрозой. Отличительным признаком цитокинового шторма
является стойкая лихорадка и неспецифические конституциональные симптомы (потеря
веса, боли в суставах и мышцах, утомляемость, головная боль). Прогрессирующее
широко распространенное системное вос-паление приводит к потере сосудистого
тонуса, что проявляется в падении артериального давления, сосудорасширяющем шоке
и прогрессирующей органной недостаточности. В этом контексте дыхательная
недостаточность является наиболее заметной, но также влияет на сердце,
центральную нервную систему и почки. Некоторые клинические проявления связаны со
специфическими цитокинами. В частности, лихорадка обусловлена во многом
повыше-нием уровня IL-6 и TNF. Синдром капиллярной утечки, который относится к
увеличению проницаемости капилляров для белков и клинически проявляется
гипотонией, отеком, острой дыхательной недостаточностью и повреждением почек,
как полагают, вызывается действием IL-2 [9]. IL-1 активно участвует в
воспалительном ответе на инфекцию, а его основными источниками являются
активированные моноциты и макрофаги. SARS-CoV-2, по-видимому, действует на
активацию и созревание IL-1β, который, в свою очередь, активи-рует другие
провоспалительные цитокины, такие как IL-6 и TNF-α [19]. Следовательно, IL-1β
является частью цитокинового шторма, вызванного коронавирусной инфекцией [10]. У
боль-шинства пациентов с COVID-19 с тяжелыми симптомами наблюдается повышенный
уровень IL-1β, что связано с атипичной пневмонией, гиперкоагуляцией и
диссеминированным вну-трисосудистым свертыванием [20].
Недавние исследования показали, что нарушение ответа на интерфероны типа 1 на
ранней стадии инфекции COVID-19 играет важную роль в развитии цитокинового
шторма, а различные цитокины, такие как IL-6 и IL-1, участвуют в тяжелой форме
COVID-19. Интерфероны типа 1 играют важную роль в подавлении ранней стадии
инфекции COVID-19. Дендритные клетки и мононуклеарные макрофаги, распознающие
вирусные антигены, вызы-вают реакцию острой фазы через провоспалительные
цитокины, такие как IL-6, IL-1 и TNF-α. Среди них IL-6 стимулирует Т-клетки для
активации адаптивного иммунитета. Активиро-ванные Т-клетки также стимулируют
макрофаги и NK-клетки через IFN-γ, способствуя удалению вируса. Отсутствие
первоначального иммунного ответа на IFN типа 1 чрезмерно увеличивает активность
иммунной системы, что приводит к цитокиновому шторму [21]. IL-2 играет ключевую
роль в пролиферации Т-клеток и в генерации эффекторных Т-клеток и Т-клеток
памяти. Он участвует в адаптивном иммунитете и увеличивает метаболизм глюкозы,
способствуя пролиферации и активации Т-, В- и NK-клеток [22]. Ряд исследователей
обнаружили повышенные уровни IL-2 или его рецептора IL-2R у пациентов с
COVID-19, причем отмечена прямо пропорциональная зависимость уровней IL-2 и
тяжести состояния пациентов [23]. IL-4 также участвует в адаптивном иммунитете,
играя решающую роль в иммунной регуляции, которой управляют активированные Т-хелперные
(Th) клетки. Он преимущественно действует через активацию, пролиферацию и
дифференцировку В-лимфо-цитов и промотирование изотипа иммуноглобулина E.
Следовательно, IL-4 решающим образом вмешивается в индукцию регулирующих
гуморальный иммунитет Th2-клеток [24]. Различные исследования пациентов с
COVID-19 выявили повышенные уровни IL-4 как часть цитокинового шторма,
связанного с тяжелыми респираторными симптомами [25].
Следует подробнее остановиться на участии в патофизиологических процессах при
инфекции SARS-CoV-2 ключевых цитокинов. IL-6 играет важную роль в раннем
иммунном ответе на инфекции, а также опосредует неконтролируемое производство и
высвобождение хемокинов и цитокинов [26]. Цитокин продуцируется моноцитами CD14
+ CD16 + после стимуляции IL-1β и TNF-α. IL-6 участвует в воспалении, иммунном
ответе и кроветворении. Эта плейотропная биомолекула секретируется несколькими
типами клеток и регулирует широкий спектр физиологических процессов [27]. На
начальных стадиях воспаления секре-тируемый IL-6 перемещается в печень и
индуцирует большое количество белков острой фазы, включая C-реактивный белок (CРБ),
сывороточный амилоид A (SAA), фибриноген, гаптоглобин и α1-антитрипсин. Кроме
того, было обнаружено, что IL-6 снижает выработку фибронектина, альбумина и
трансферрина. Значительно повышенные концентрации IL-6 могут иметь решающее
значение для тяжелых воспалительных состояний при COVID-19. Было обнаружено, что
уровни IL-6 в сыворотке крови значимо повышены у пациентов в критическом
состоянии; по сравнению с умеренными случаями COVID-19, его уровни прямо
коррелируют с тяжестью заболевания [28]. Ruan Q. et.al. в своем исследовании
констатиро-вали тот факт, что уровень IL-6 был значительно повышен у умерших
пациентов в сравнении с выжившими от COVID-19. Это наблюдение позволило авторам
предположить, что смертность от COVID-19 может быть связана с активированным
вирусом цитокиновым штормом [29]. Herold T. et al. показали, что высокий уровень
IL-6 у пациентов с COVID-19 является предиктором необходимости механической
вентиляции легких [30]. Недавнее прос-пективное когортное исследование позволило
заключить, что высокие уровни IL-6 и d-димер отражали системное воспаление и
тромботическое состояние и предсказывали внутри-больничную смертность от
COVID-19 [31]. Повышенные уровни IL-6 были обнаружены у пациентов с COVID-19 и
связаны с плохим прогнозом [32,33]. Wan S. с соавт. обнаружили повышенный
уровень IL-6 у одной трети пациентов с легкими симптомами и у трех четвер-тей
пациентов с тяжелыми симптомами, сделав вывод, что IL-6, наряду с IL-10, может
иметь прогностическое значение у пациентов с COVID-19 [34]. Было
продемонстрировано, что высокая экспрессия IL-6 у пациентов с COVID-19 может
ускорять воспалительный процесс, способствуя цитокиновому шторму и ухудшая
прогноз. Цитокиновый шторм, включая повышенные уровни IL-6, также был связан с
поражением сердца у пациентов с COVID-19 [35].
IL-10 представляет собой цитокин 2 типа, который ингибирует продукцию
провоспалительных цитокинов (например, IFNγ, TNFα, IL-1β и IL-6) в различных
типах клеток и предотвращает созревание дендритных клеток, блокируя IL-12. Он
препятствует экспрессии основного комплекса гистосовместимости и костимулирующих
молекул, кото-рые играют важную роль в клеточном иммунитете. Однако IL-10 может
оказывать иммуно-стимулирующее действие, включая стимуляцию продукции IFNγ CD8 +
Т-клетками. Это также мощный фактор для роста и дифференцировки В-клеток, тучных
клеток и тимоцитов [36]. Многие авторы обнаружили увеличение содержания IL-10 у
пациентов с COVID-19 и связали его уровни с тяжестью и прогрессированием
заболевания [23,25,32]. Имеется сооб-щение о том, что определение содержания
IL-10 у пациентов с инфекцией SARS-CoV-2 может использоваться для прогноза
заболевания [34].
IL-17 синтезируется лимфоцитами Th17, и его содержание повышается при
воспали-тельных процессах и аутоиммунных заболеваниях. Он также продуцируется
клетками CD8 + и различными наборами незрелых лимфоцитов, включая гамма-дельта
Т-клетки, NK-клетки и врожденные лимфоидные клетки группы 3 [37]. Повышенные
уровни IL-17 были зареги-стрированы у пациентов с SARS-CoV-2 как часть
цитокинового шторма и они были связаны с вирусной нагрузкой и тяжестью
заболевания [38,39]. Тот факт, что клетки Th17 могут, среди прочего,
продуцировать IL-17, привел к предложениям о терапевтическом подходе к COVID-19,
ориентированном на ингибитор янус-киназы 2 (JAK2) под названием федра-тиниб.
Этот ингибитор JAK2 снижает экспрессию IL-17 клетками Th17 на мышиных моделях
[40].
TNF-α продуцируется различными типами клеток, такими как моноциты, макрофаги
и Т-клетки. Этот цитокин связан с провоспалительными ответами, опосредованными
IL-1β и IL-6. Наряду с другими цитокинами TNF-α участвует в регуляции
воспалительных процессов, инфекционных заболеваний и злокачественных опухолей.
Было замечено, что уровни TNF-α в сыворотке повышены у пациентов с COVID-19 и их
повышение коррелировало с более тяжелым течением болезни [40].
Считается, что основными патологическими эффекторами при COVID-19 являются
IL-6 и макрофаги. IL-6 - важный провоспалительный цитокин, обладающий
плейотропным действием. Это вызвано инфекцией или повреждением тканей и быстро
вызывает острые реакции, чтобы свести их к минимуму. IL-6 способствует выработке
различных белков острой фазы в гепатоцитах и индуцирует дифференцировку
иммунных клеток, таких как B- и T-клетки. Кроме того, IL-6 участвует в
метаболизме железа, регулируя гепсидин, что делает микроокружение устойчивым к
инфекции. Взятые вместе, IL-6 играет роль в инициации воспалительных реакций и в
активации адаптивного иммунитета против инфекции или повреждения [41]. В связи с
тем, что на данный момент только разрабатывается этиотропная терапия SARS-CoV-2,
актуальным являются клинико-фармакологические подходы к патоге-нетическому
лечению COVID-19, минимизации иммунологических осложнений в виде синдрома
активации макрофагов, приводящего к синдрому цитокинового шторма. Именно раннее
фармакологическое вмешательство при указанных иммунологических осложнениях
уменьшит тяжесть заболевания и смертность при инфекции COVID-19. Учитывая, что
вторичный синдром активации макрофагов (MAS)/гемофагоцитарный лимфогистоцитоз (ГЛГ)
при COVID-19 является следствием массированной неконтролируемой активации
иммунной системы (гипериммунной реакции), спровоцированной острой вирусной
инфек-цией, пациентам, наряду с симптоматическим и этиотропным лечением, в
большинстве случаев должна проводиться патогенетическая иммуносупрессивная
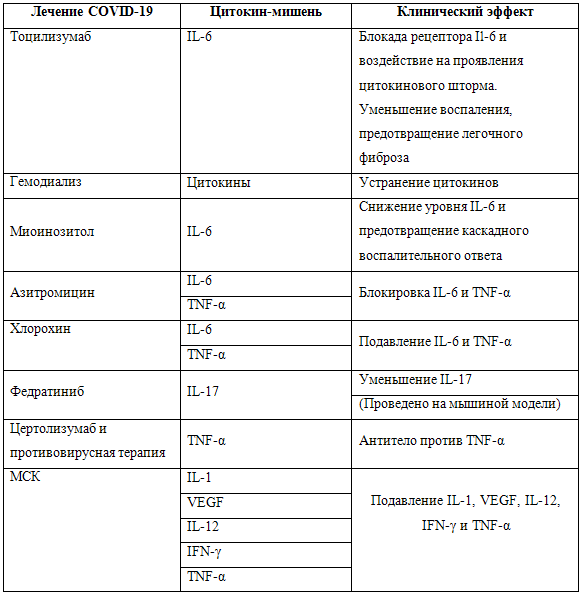
терапия [42]. В таблице 1 приведена информация о некоторых подходах в лечении
инфекции SARS-CoV-2 [11].
Таблица 1. Некоторые экспериментальные методы лечения инфекции SARS-CoV-2 (цит. по
Costela-Ruiz V.J. et al. [11]
В настоящее время продолжаются клинические исследования эффективности и
безопасности таргетных препаратов у пациентов с тяжелым/критическим течением
коронавирусной инфекции. Учитывая особенности течения заболевания при
инфицировании Дельта-штаммом SARS-CoV-2 (раннее развитие гипериммунной реакции и
массивного поражения легких), патогенетическую терапию, включая терапевтические
схемы, применяе-мые в амбулаторных условиях, целесообразно инициировать на
ранних этапах болезни. Алгоритмы патогенетического лечения COVID-19 представлены
в виде альтернативных терапевтических схем, включающих генно-инженерные
биологические препараты (ГИБП) и/или ГКС [2].
С позиции клинической фармакологии обосновано положение о том, что
потенци-альная целевая терапия при этом – использование блокаторов и
нейтрализаторов IL-6 [43]. В 13 версии Временных методических рекомендаций МЗ РФ
по лечебно-профилактическим мероприятиям при COVID-19 (2021г.) указывается, что
уже на ранних стадиях гемофагоци-тарного синдрома (ГФС) целесообразно назначение
человеческих моноклональных антител к рецептору IL-6 (тоцилизумаба или
сарилумаба) с целью подавления цитокинового шторма и предотвращения развития
полиорганной недостаточности, ведущей к летальному исходу [2]. Следует заметить,
что в течение ряда лет группа ингибиторов биологических эффектов IL-6 была
представлена одним препаратом – тоцилизумабом [44]. Новый препарат из этой
группы сарилумаб – человеческое моноклональное антитело (подтип IgG1) к
рецептору IL-6. Сарилумаб специфически связывается как с растворимыми, так и с
мембранными рецеп-торами IL-6 (IL-6Rα) и подавляет IL-6-опосредованную передачу
сигнала с вовлечением сигнального белка – гликопротеина 130 (gp130) и сигнальных
белков STAT-3. Сарилумаб отличается более выраженной аффинностью в отношении
связывания рецептора IL-6, а также связывает рецептор более стабильно, чем
тоцилизумаб. Сарилумаб по своим характе-ристикам близок к тоцилизумабу, хотя
имеются и значимые различия. Так, сарилумаб – это антитело, идентичное
человеческому, тогда как тоцилизумаб – гуманизированное антитело, то есть
содержащее некоторое количество мышиного белка. Характерной чертой сарилумаба
считается отсутствие комплемент-опосредованной и антителозависимой
цитотоксичности. Имеется достаточно клинических данных, чтобы заключить, что
сарилумаб, как новый представитель класса ингибиторов биологических эффектов
IL-6, имеет значительные перспективы для широкого внедрения в практику лечения
больных с иммунопато-логическими состояниями, включая возникающий ГФС при
SARS-CoV-2 [45].
В настоящее время используется несколько подходов для лечения наблюдаемого
при инфекции SARS-CoV-2 цитокинового шторма и определенные ожидания связаны с
приме-нением лекарственных препаратов, ингибирующих пути JAK. JAK - это
внутриклеточная тирозинкиназа, которая опосредует сигналы цитокинов, гормонов и
факторов роста. Преоб-разователь сигнала киназы Janus и активатор пути
транскрипции (JAK / STAT) обычно участвует в различных процессах активации
цитокинов. Ингибиторы JAK, включая руксолитиниб и барицитиниб, используются для
лечения различных аутоиммунных и гематологических заболеваний. Считается, что
ингибирование JAK может эффективно подавлять цитокиновый шторм, поскольку оно
может неизбирательно подавлять активность многих цитокинов. Подавление JAK при
COVID-19 дает два клинических преимущества. Ингибиторы JAK блокируют передачу
сигналов цитокинов, тем самым снижая чрезмерные воспалительные реакции, а также
проникновение SARS-CoV-2 на ранней стадии инфекции [46]. Как сообщалось выше,
вирус SARS-CoV-2 проникает в организм через рецептор ангиотензин-превращающего
фермента-2 (ACE2) на альвеолярных клетках 2 типа в легких, и несколько
регуляторов участвуют в опосредовании эндоцитоза и внутриклеточного транс-порта
через ACE2. AP2-ассоциированная протеинкиназа-1, один из таких регуляторов,
является мишенью ингибиторов JAK, особенно барицитиниба. Таким образом,
ингибиторы JAK могут препятствовать проникновению и распространению SARS-CoV-2
[47]. Соответ-ственно, некоторые ингибиторы JAK, включая барицитиниб,
руксолитиниб и федратиниб, изучаются для лечения тяжелой формы COVID-19. В
частности, Cantini F. et al. в многоцентровом ретроспективном исследовании
обнаружили тот факт, что барицитиниб снижал частоту госпитализаций и летальных
исходов в ОИТР, а также увеличивал число выздоровевших пациентов [48].
Пожилой и старческий возраст не является противопоказаниями для применения
моноклональных антител к цитокинам и их рецепторам. Пациентам, получающим
лечение иммунодепрессантами при трансплантации органов, назначение данных
препаратов возможно по решению врачебной комиссии с коррекцией исходной базовой
иммуносуп-рессивной терапии. Необходимо однако помнить о том, что на фоне
терапии блокаторами IL-6 могут возникать нежелательные явления - инфекционные
заболевания: бактериальная пневмония, флегмона, инфекции, вызванные Herpes
zoster, и др.; сыпь, крапивница; повы-шение показателей липидного обмена (общего
холестерина, триглицеридов, ЛПВП, ЛПНП). Противопоказания для назначения
генно-инженерных биологических препаратов: сепсис, подтвержденный наличием
патогенов, отличных от COVID-19; гиперчувствительность к любому компоненту
препарата; вирусный гепатит В; иммуносупрессивная терапия при трансплантации
органов; нейтропения < 0,5Ч109/л; повышение активности АСТ или АЛТ более чем в 5
норм; тромбоцитопения < 50Ч109/л; применение ГИБП при беременности возможно в
случае, если потенциальная польза превышает риск [2].
При рассмотрении любого патологического состояния практический интерес для
врачей представляют данные о гендерных особенностях течения той или иной
патологии. В обзорной статье Л.С. Намазовой-Барановой с соавт. [49]
анализируются литературные данные о гендерном неравенстве при реализации болезни,
когда среди заболевших и умерших мужчины явно превалировали. Было обращено
внимание на факт того, что уже с момента вспышки в Китае наблюдался явный
гендерный дисбаланс среди заболев-ших/госпитализированных/умерших. Так,
соотношение заболевших мужчин и женщин было примерно 2:1, а риск умереть был
существенно выше у мужчин, чем у женщин (летальность в КНР среди заболевших –
1,7% у женщин и 2,8% у мужчин, среди госпитализированных в госпитали Гонконга
вероятность попасть в реанимацию или умереть была у мужчин более чем в 2 раза
выше, чем у женщин, – 32 и 15% соответственно). Это же гендерное неравенство
было отмечено и в других регионах мира. Отдаленные последствия заболевания (постковид-ный
синдром) у женщин в силу действия социальных и психологических факторов могут
быть хуже, чем у мужчин, что диктует необходимость активного применения
реабилита-ционных технологий после выздоровления именно у женщин. Публикации,
касающиеся детей, также подтверждают факт явных гендерных и этнических различий
среди заболевших COVID-19 [49]. Эти факты заставили ученых провести исследование,
в результате которого было объяснено, что двойные Х-хромосомы у женщин являются
своего рода защитой от нового коронавируса, ведь гены одного из рецепторов,
ответственных за вхождение вируса в клетку (ACE2, но не TMPRSS2), находятся как
раз на женской хромосоме [50]. Кроме того, именно на Х-хромосомах находятся гены,
ответственные за реализацию клеточного и гумо-рального иммунитета, а также за
развитие воспаления.
На наш взгляд, следует обратить пристальное внимание на важное сообщение
группы авторов - ученых из Медицинского отделения Рэдклиффа (Downes D.J. et al.,
2021) об обнаружении гена, наличие которого ассоциировано с двукратным
повышением риска дыхательной недостаточности при COVID-19. Авторами осуществлен
полногеномный поиск ассоциаций (GWAS) для обнаружения генов, которые осложняют
течение коронавирусной инфекции. На первом этапе указанные исследователи
идентифицировали участок ДНК на 3 хромосоме (3p21.31 гаплотип), который в 2 раза
увеличивал риск смертельного исхода от коронавирусной инфекции у людей старше 65
лет. Дальнейшие исследования позволили выявить среди генов-кандидатов
эффекторный ген-кандидат в локусе риска COVID-19 - ген LZTFL1. Предполагается,
что изменения в этом гене регулируют эпителиально-мезен-химальный переход в
эпителиальных клетках дыхательных путей, что делает их менее защищенными от
воздействия вируса SARS-CoV-2. Исследователи надеются на возможность таргетного
воздействия на это звено патогенеза – препараты, которые предотвращали бы
развитие эпителиально-мезенхимальной трансформации и предотвращали или
минимизиро-вали проявления острого дистресс-синдрома у пациентов. По имеющимся
оценкам, около 60% населения Южной Азии имеют соответствующие изменения в этом
гене в сравнении с 15% в европейской популяции. Обнаруженный генетический фактор
дает понимание того, почему определенные популяции чаще переносят коронавирусную
инфекцию в тяжелой форме, а также определяет исследовательский вектор в
дальнейшей разработке препаратов против инфекции SARS-CoV-2 (COVID-19) [51].
С учетом приведенных выше данных следует заключить, что по мере накопления
современных сведений по иммунопатогенезу новой короновирусной инфекции
SARS-CоV-2 (COVID-19) в настоящее время используется несколько подходов для
лечения наблюдаемого цитокинового шторма, связанного с COVID-19. Практический
интерес с позиций клинической фармакологии представляют новые подходы к лечению
инфекции SARS-CоV-2 (COVID-19), нацеленных на блокаду цитокинов. В частности,
это использование ингиби-торов IL-6 (тоцилизумаба, сарилумаба), ингибиторов IL-1
(анакинры), ингибиторов пути янус-киназы (JAK) (барицитиниба). В недавних
исследованиях многих авторов реализация подобных подходов показала
многообещающий потенциал для лечения тяжелых форм COVID-19 [13,21,52,53,54].
Литература /References
1. World Health Organization. COVID-19 Clinical management: living guidance.
25 January 2021.
2. Временные методические рекомендации. Профилактика, диагностика и лечение
новой короновирусной инфекции (COVID-19). Версия 13. 2021. МЗ РФ. [Vremennye
metodicheskie rekomendacii. Profilaktika, diagnostika i lechenie novoj
koronovirusnoj infekcii (COVID 19). Versija 13. 2021. MZ RF. (in Russian).]
3. Zhou P. et al. A pneumonia outbreak associated with a new coronavirus of
probable bat origin. Nature. 2020; 579 (7798): 270-273.
4. Zhang H. et al. Angiotensin-converting enzyme 2 (ACE2) as a SARSCoV-2
receptor: molecular mechanisms and potential therapeutic target. Intensive Care
Med. 2020; 46 (4): 586-590.
5. Hoffmann M. et al. SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and
Is Blocked by a Clinically Proven Protease Inhibitor. Cell. 2020; 181: 1-10.
6. Самсонова М. В. с соавт. Особенности патологической анатомии легких при
COVID-19. Пульмонология. 2020; 30 (5): 519-532. [Samsonova M. V. s soavt.
Osobennosti patologicheskoj anatomii legkih pri COVID-19. Pul'monologija. 2020;
30 (5): 519-532. (in Russian).]
7. Poland G.A., Ovsyannikova I.G., Kennedy R.B. SARSCoV-2 immunity: review
and applications to phase 3 vaccine candidates. Lancet. 2020; 396 (10262):
1595-1606.
8. Hu B. et al. The cytokine storm and COVID-19. J Med Virol. 2021; 93 (1):
250-256.
9. Mangalmurti N., Hunter C.A. Cytokine Storms: Understanding COVID-19.
Immunity. 2020; 14; 53 (1): 19–25.
10. Mehta P. et al. COVID-19: consider cytokine storm syndromes and
immunosuppression. Lancet. 2020; 395: 1033–1034.
11. Costela-Ruiz V.J. et al. SARS-CoV-2 infection: The role of cytokines in
COVID-19 disease Cytokine Growth Factor Rev. 2020; 54: 62–75.
12. Han S., Mallampalli R.K. The acute respiratory distress syndrome: From
mechanism to translation. J. Immunol. 2015; 194: 855–860.
13. Pum A. et al. Cytokines and Chemokines in SARS-CoV-2
Infections—Therapeutic Strategies Targeting Cytokine Storm. Biomolecules. 2021;
11 (1): 91.
14. Yang J. et al. Prevalence of comorbidities and its effects in patients
infected with SARS-CoV-2: A systematic review and meta-analysis. Int. J. Infect.
Dis. 2020; 94: 91–95.
15. Coperchini F. et al. The cytokine storm in COVID-19: An overview of the
involvement of the chemokine/chemokine-receptor system. Cytokine Growth Factor
Rev. 2020; 53: 25–32.
16. Bartee E., McFadden G. Cytokine synergy: an underappreciated contributor
to innate anti-viral immunity. Cytokine. 2013; 63: 237–240.
17. Vabret N. et al. Immunology of COVID-19: current state of the science.
Immunity. 2020; 52 (6): 910-941.
18. Blanco-Melo D. et al. Imbalanced host response to SARS-CoV-2 drives
development of COVID-19. Cell. 2020; 181 (5): 1036-1045.
19. Siu K.-L. et al. Severe acute respiratory syndrome coronavirus ORF3a
protein activates the NLRP3 inflammasome by promoting TRAF3-dependent
ubiquitination of ASC. FASEB J. 2019; 33 (8): 8865–8877.
20. Zhang W. et al. The use of anti-inflammatory drugs in the treatment of
people with severe coronavirus disease 2019 (COVID-19): the perspectives of
clinical immunologists from China. Clin. Immunol. 2020; 214: 108393.
21. Kim J.S. et al. Immunopathogenesis and treatment of cytokine storm in
COVID-19. Theranostics. 2021; 11(1): 316–329.
22. Turner M.D. et al. Cytokines and chemokines: at the crossroads of cell
signalling and inflammatory disease. Biochim. Biophys. Acta. 2014;1843:
2563–2582.
23. Chen G. et al. Clinical and immunologic features in severe and moderate
Coronavirus Disease 2019. J. Clin. Invest. 2020; 130(5): 2620-2629.
24. Yang X.-X. et al. Association of TGF-beta1, IL-4 and IL-13 gene
polymerphisms with asthma in a Chinese population. Asian Pac. J. Allergy Immunol.
2011; 29: 273–277.
25. Chen C. et al. Advances in the research of cytokine storm mechanism
induced by Corona Virus Disease 2019 and the corresponding immunotherapies.
Zhonghua Shao Shang Za Zhi. 2020; 36: E005.
26. Brocker C. et al. Evolutionary divergence and functions of the human
interleukin (IL) gene family. Hum. Genom. 2010; 5: 30–55.
27. Rincon M., Irvin C.G. Role of IL-6 in asthma and other inflammatory
pulmonary diseases. Int. J. Biol. Sci. 2012; 8: 1281–1290.
28. Copaescu A. et al. The role of IL-6 and other mediators in the cytokine
storm associated with SARS-CoV-2 infection. J. Allergy Clin. Immunol. 2020; 146:
518–534.
29. Ruan Q. et al. Clinical predictors of mortality due to COVID-19 based on
an analysis of data of 150 patients from Wuhan, China. Intensive Care Med. 2020;
46(5): 846–848.
30. Herold T. et al. Elevated levels of IL-6 and CRP predict the need for
mechanical ventilation in COVID-19. J Allergy Clin Immunol. 2020; 146(1):
128–136.e4.
31. Cummings M.J. et al. Epidemiology, clinical course, and outcomes of
critically ill adults with COVID-19 in New York City: a prospective cohort
study. Lancet. 2020; 395(10239): 1763–1770.
32. Pedersen S.F., Ho Y.-C. SARS-CoV-2: a storm is raging. J. Clin. Invest.
2020; 130(5): 2202-2205.
33. Wu C. et al. Risk Factors Associated With Acute Respiratory Distress
Syndrome and Death in Patients With Coronavirus Disease 2019 Pneumonia in Wuhan,
China. JAMA Intern. Med. 2020; 180(7): 934-943.
34. Wan S. et al. Characteristics of lymphocyte subsets and cytokines in
peripheral blood of 123 hospitalized patients with 2019 novel coronavirus
pneumonia (NCP). The Preprint Server For Health Sciences. Hematology. 2020.
https://doi.org/10.1101/2020.02.10.20021832.
35. Akhmerov A., Marban E. COVID-19 and the heart. Circ. Res. 2020; 126:
1443–1455.
36. Saraiva M., O’Garra A. The regulation of IL-10 production by immune
cells. Nat. Rev. Immunol. 2010; 10: 170–181.
37. Cua D.J., Tato C.M. Innate IL-17-producing cells: the sentinels of the
immune system. Nat. Rev. Immunol. 2010; 10: 479–489.
38. Huang C. et al. Clinical features of patients infected with 2019 novel
coronavirus in Wuhan, China. Lancet. 2020; 395: 497–506.
39. Liu Y. et al. 2019-novel Coronavirus (2019-nCoV) Infections Trigger an
Exaggerated Cytokine Response Aggravating Lung Injury. http://www.chinaxiv.org/abs/202002.00018
(accessed April 30, 2020).
40. Wu D., Yang X.O. TH17 responses in cytokine storm of COVID-19: an
emerging target of JAK2 inhibitor Fedratinib. J. Microbiol. Immunol. Infect.
2020; 53(3): 368-370.
41. Tanaka T., Narazaki M., Kishimoto T. IL-6 in inflammation, immunity, and
disease. Cold Spring Harb Perspect Biol. 2014; 6(10): a016295.
42. Felsenstein S. et al. COVID-19: Immunology and treatment options. Clin
Immunol. 2020; 215: 108448.
43. Coperchini F., Chiovato L., Rotondi M. Interleukin-6, CXCL10 and
Infiltrating Macrophages in COVID-19-Related Cytokine Storm: Not One for All But
All for One! Front Immunol. 2021; 12: 668507.
44. Pelaia C. et al. Therapeutic Role of Tocilizumab in SARS-CoV-2-Induced
Cytokine Storm: Rationale and Current Evidence. Int J Mol Sci. 2021; 22(6):
3059.
45. Инструкция по медицинскому применению. Сарилумаб (Кевзара). Видаль:
справочник лекарственных средств. Дата перерегистрации 24.01.2019. [Instrukcija
po medicinskomu primeneniju. Sarilumab (Kevzara). Vidal': spravochnik
lekarstvennyh sredstv. Data pereregistracii 24.01.2019. (in Russian).]
46. Seif F. et al. JAK Inhibition as a New Treatment Strategy for Patients
with COVID-19. Int Arch Allergy Immunol. 2020; 181(6): 467–475.
47. Richardson P. et al. Baricitinib as potential treatment for 2019-nCoV
acute respiratory disease. Lancet. 2020; 395(10223 e): 30–31.
48. Cantini F. et al. Beneficial impact of Baricitinib in COVID-19 moderate
pneumonia; multicentre study. The Journal of infection. 2020;
S0163-4453(20)30433-3.
49. Намазова-Баранова Л.С., Баранов А.А. COVID-19: что педиатры узнали об
особенностях иммунного ответа на новую коронавирусную инфекцию за год борьбы с
ней. Педиатрия им. Г.Н. Сперанского. 2020; 99 (6): 32–51. [Namazova-Baranova L.S.,
Baranov A.A. COVID-19: chto pediatry uznali ob osobennostjah immunnogo otveta na
novuju koronavirusnuju infekciju za god bor'by s nej. Pediatrija im. G.N.
Speranskogo. 2020; 99 (6): 32–51. (in Russian).]
50. Gemmati D. et al. COVID-19 and individual genetic
susceptibility/receptivity: Role of ACE1/ACE2 genes, immunity, inflammation and
coagulation. Might the double X-chromosome in females be protective against
SARS-CoV-2 compared to the single X-chromosome in males? Int. J. Mol. Sci. 2020;
21(10): 3474.
51. Downes D.J. et al. Identification of LZTFL1 as a candidate effector gene
at a COVID-19 risk locus. Nat Genet. 2021; 53: 1606–1615.
52. Salian V.S. et al. COVID-19 Transmission, Current Treatment, and Future
Therapeutic Strategies. Mol Pharm. 2021; 18(3): 754-771.
53. Majumder J., Minko T. Recent Developments on Therapeutic and Diagnostic
Approaches for COVID-19. AAPS J. 2021; 23(1): 14.
54. Naik R.R., Shakya A.K. Therapeutic Strategies in the Management of
COVID-19. Front. Mol. Biosci. 2021; 7: 636738.
References
1. World Health Organization. COVID-19 Clinical management: living guidance.
25 January 2021.
2. Temporary guidelines. Prevention, diagnosis and treatment of new
coronavirus infection (COVID-19). Version 13.2021. Ministry of Health of the
Russian Federation. [(in Russian)]
3. Zhou P. et al. A pneumonia outbreak associated with a new coronavirus of
probable bat origin. Nature. 2020; 579 (7798): 270-273.
4. Zhang H. et al. Angiotensin-converting enzyme 2 (ACE2) as a SARSCoV-2
receptor: molecular mechanisms and potential therapeutic target. Intensive Care
Med. 2020; 46 (4): 586-590.
5. Hoffmann M. et al. SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and
Is Blocked by a Clinically Proven Protease Inhibitor. Cell. 2020; 181: 1-10.
6. Samsonova MV et al. Features of the pathological anatomy of the lungs in
COVID-19. Pulmonology. 2020; 30 (5): 519-32. [(in Russian)]
7. Poland G.A., Ovsyannikova I.G., Kennedy R.B. SARSCoV-2 immunity: review
and applications to phase 3 vaccine candidates. Lancet. 2020; 396 (10262):
1595-1606.
8. Hu B. et al. The cytokine storm and COVID-19. J Med Virol. 2021; 93 (1):
250-256.
9. Mangalmurti N., Hunter C.A. Cytokine Storms: Understanding COVID-19.
Immunity. 2020; 14; 53 (1): 19–25.
10. Mehta P. et al. COVID-19: consider cytokine storm syndromes and
immunosuppression. Lancet. 2020; 395: 1033–1034.
11. Costela-Ruiz V.J. et al. SARS-CoV-2 infection: The role of cytokines in
COVID-19 disease Cytokine Growth Factor Rev. 2020; 54: 62–75.
12. Han S., Mallampalli R.K. The acute respiratory distress syndrome: From
mechanism to translation. J. Immunol. 2015; 194: 855–860.
13. Pum A. et al. Cytokines and Chemokines in SARS-CoV-2
Infections—Therapeutic Strategies Targeting Cytokine Storm. Biomolecules. 2021;
11 (1): 91.
14. Yang J. et al. Prevalence of comorbidities and its effects in patients
infected with SARS-CoV-2: A systematic review and meta-analysis. Int. J. Infect.
Dis. 2020; 94: 91–95.
15. Coperchini F. et al. The cytokine storm in COVID-19: An overview of the
involvement of the chemokine/chemokine-receptor system. Cytokine Growth Factor
Rev. 2020; 53: 25–32.
16. Bartee E., McFadden G. Cytokine synergy: an underappreciated contributor
to innate anti-viral immunity. Cytokine. 2013; 63: 237–240.
17. Vabret N. et al. Immunology of COVID-19: current state of the science.
Immunity. 2020; 52 (6): 910-941.
18. Blanco-Melo D. et al. Imbalanced host response to SARS-CoV-2 drives
development of COVID-19. Cell. 2020; 181 (5): 1036-1045.
19. Siu K.-L. et al. Severe acute respiratory syndrome coronavirus ORF3a
protein activates the NLRP3 inflammasome by promoting TRAF3-dependent
ubiquitination of ASC. FASEB J. 2019; 33 (8): 8865–8877.
20. Zhang W. et al. The use of anti-inflammatory drugs in the treatment of
people with severe coronavirus disease 2019 (COVID-19): the perspectives of
clinical immunologists from China. Clin. Immunol. 2020; 214: 108393.
21. Kim J.S. et al. Immunopathogenesis and treatment of cytokine storm in
COVID-19. Theranostics. 2021; 11(1): 316–329.
22. Turner M.D. et al. Cytokines and chemokines: at the crossroads of cell
signalling and inflammatory disease. Biochim. Biophys. Acta. 2014;1843:
2563–2582.
23. Chen G. et al. Clinical and immunologic features in severe and moderate
Coronavirus Disease 2019. J. Clin. Invest. 2020; 130(5): 2620-2629.
24. Yang X.-X. et al. Association of TGF-beta1, IL-4 and IL-13 gene
polymerphisms with asthma in a Chinese population. Asian Pac. J. Allergy Immunol.
2011; 29: 273–277.
25. Chen C. et al. Advances in the research of cytokine storm mechanism
induced by Corona Virus Disease 2019 and the corresponding immunotherapies.
Zhonghua Shao Shang Za Zhi. 2020; 36: E005.
26. Brocker C. et al. Evolutionary divergence and functions of the human
interleukin (IL) gene family. Hum. Genom. 2010; 5: 30–55.
27. Rincon M., Irvin C.G. Role of IL-6 in asthma and other inflammatory
pulmonary diseases. Int. J. Biol. Sci. 2012; 8: 1281–1290.
28. Copaescu A. et al. The role of IL-6 and other mediators in the cytokine
storm associated with SARS-CoV-2 infection. J. Allergy Clin. Immunol. 2020; 146:
518–534.
29. Ruan Q. et al. Clinical predictors of mortality due to COVID-19 based on
an analysis of data of 150 patients from Wuhan, China. Intensive Care Med. 2020;
46(5): 846–848.
30. Herold T. et al. Elevated levels of IL-6 and CRP predict the need for
mechanical ventilation in COVID-19. J Allergy Clin Immunol. 2020; 146(1):
128–136.e4.
31. Cummings M.J. et al. Epidemiology, clinical course, and outcomes of
critically ill adults with COVID-19 in New York City: a prospective cohort
study. Lancet. 2020; 395(10239): 1763–1770.
32. Pedersen S.F., Ho Y.-C. SARS-CoV-2: a storm is raging. J. Clin. Invest.
2020; 130(5): 2202-2205.
33. Wu C. et al. Risk Factors Associated With Acute Respiratory Distress
Syndrome and Death in Patients With Coronavirus Disease 2019 Pneumonia in Wuhan,
China. JAMA Intern. Med. 2020; 180(7): 934-943.
34. Wan S. et al. Characteristics of lymphocyte subsets and cytokines in
peripheral blood of 123 hospitalized patients with 2019 novel coronavirus
pneumonia (NCP). The Preprint Server For Health Sciences. Hematology. 2020.
https://doi.org/10.1101/2020.02.10.20021832.
35. Akhmerov A., Marban E. COVID-19 and the heart. Circ. Res. 2020; 126:
1443–1455.
36. Saraiva M., O’Garra A. The regulation of IL-10 production by immune
cells. Nat. Rev. Immunol. 2010; 10: 170–181.
37. Cua D.J., Tato C.M. Innate IL-17-producing cells: the sentinels of the
immune system. Nat. Rev. Immunol. 2010; 10: 479–489.
38. Huang C. et al. Clinical features of patients infected with 2019 novel
coronavirus in Wuhan, China. Lancet. 2020; 395: 497–506.
39. Liu Y. et al. 2019-novel Coronavirus (2019-nCoV) Infections Trigger an
Exaggerated Cytokine Response Aggravating Lung Injury. http://www.chinaxiv.org/abs/202002.00018
(accessed April 30, 2020).
40. Wu D., Yang X.O. TH17 responses in cytokine storm of COVID-19: an
emerging target of JAK2 inhibitor Fedratinib. J. Microbiol. Immunol. Infect.
2020; 53(3): 368-370.
41. Tanaka T., Narazaki M., Kishimoto T. IL-6 in inflammation, immunity, and
disease. Cold Spring Harb Perspect Biol. 2014; 6(10): a016295.
42. Felsenstein S. et al. COVID-19: Immunology and treatment options. Clin
Immunol. 2020; 215: 108448.
43. Coperchini F., Chiovato L., Rotondi M. Interleukin-6, CXCL10 and
Infiltrating Macrophages in COVID-19-Related Cytokine Storm: Not One for All But
All for One! Front Immunol. 2021; 12: 668507.
44. Pelaia C. et al. Therapeutic Role of Tocilizumab in SARS-CoV-2-Induced
Cytokine Storm: Rationale and Current Evidence. Int J Mol Sci. 2021; 22(6):
3059.
45. Instructions for medical use. Sarilumab (Kevzara). Vidal: a reference
book of medicines. Reregistration date 24.01.2019. [(in Russian)]
46. Seif F. et al. JAK Inhibition as a New Treatment Strategy for Patients
with COVID-19. Int Arch Allergy Immunol. 2020; 181(6): 467–475.
47. Richardson P. et al. Baricitinib as potential treatment for 2019-nCoV
acute respiratory disease. Lancet. 2020; 395(10223 e): 30–31.
48. Cantini F. et al. Beneficial impact of Baricitinib in COVID-19 moderate
pneumonia; multicentre study. The Journal of infection. 2020;
S0163-4453(20)30433-3.
49. Namazova-Baranova L.S., Baranov A.A. COVID-19: what pediatricians have
learned about the characteristics of the immune response to a new coronavirus
infection in a year of fighting it. Pediatrics. G.N.Speransky. 2020; 99 (6):
32-51. [(in Russian)]
50. Gemmati D. et al. COVID-19 and individual genetic
susceptibility/receptivity: Role of ACE1/ACE2 genes, immunity, inflammation and
coagulation. Might the double X-chromosome in females be protective against
SARS-CoV-2 compared to the single X-chromosome in males? Int. J. Mol. Sci. 2020;
21(10): 3474.
51. Downes D.J. et al. Identification of LZTFL1 as a candidate effector gene
at a COVID-19 risk locus. Nat Genet. 2021; 53: 1606–1615.
52. Salian V.S. et al. COVID-19 Transmission, Current Treatment, and Future
Therapeutic Strategies. Mol Pharm. 2021; 18(3): 754-771.
53. Majumder J., Minko T. Recent Developments on Therapeutic and Diagnostic
Approaches for COVID-19. AAPS J. 2021; 23(1): 14.
54. Naik R.R., Shakya A.K. Therapeutic Strategies in the Management of
COVID-19. Front. Mol. Biosci. 2021; 7: 636738.
Сведения об авторе: Василевский Игорь Вениаминович, доктор медицинских наук,
профессор кафедры клинической фармакологии БГМУ, член редколлегии журнала «Здравоохранение», HEALTHCARE, автор около 740 научных публикаций.
Опубликовано: Здравоохранение. HEALTHCARE. 2022; 3: 31-41.

